
Welche Chance bietet Ganoderma lucidum in der Behandlung menschlicher Krebserkrankungen?
Forschungsarbeit vom 31.03.2025, Hochschule Anhalt Fachbereich Landwirtschaft, Ökotrophologie und Landschaftsentwicklung.
Abschlussnote: 1.3
Gliederung / Inhaltsverzeichnis
2. Einleitung
2.1 Historische Einordnung
2.2 Biologische Einordnung
2.3 Pharmakologisch wirksame Bestandteile
2.4 Chancen in Bezug auf weitere Erkrankungen
3. Ziel
4. Theorieteil
5. Methode
6. Ergebnisse
6.1 Alleintherapeutikum
6.2 Wirkverstärker für konventionelle Krebsbehandlungen
6.3 Senkung der Nebenwirkungen konventioneller Behandlungen
6.4 Alle vorgenannten Eigenschaften
7. Diskussion
9. Anhang
1. Fragestellung
Welche Chance bietet Ganoderma lucidum in der Behandlung menschlicher Krebserkrankungen?
Ganoderma lucidum (Glänzender Lackporling [dt.], Reishi [jap.], Ling Zhi [chin.]): zytotoxisch, antiproliferativ, antitumoral, proapoptotisch, antimetastatisch

Abbildung 1: Ganoderma lucidum (Oke u.a. 2022, S. 7)
2. Einleitung
2.1 Historische Einordnung
Bereits der vor 5.250 Jahren ermordete Mann, der 1991 mumifiziert in den Ötztaler Alpen gefunden und als Ötzi bekannt wurde, hatte einen Beutel mit Pilzen bei sich. In diesem Beutel haben Forscher ein Stück Birkenporling sowie ein Stück Zunderschwamm identifiziert. Es wird vermutet, dass die Pilze als „Hausapotheke“ gedacht waren. (Wirz-Ridolfi 2019)
Daraus lässt sich schließen, dass Pilze schon in ältester Vorzeit als Heilmittel bekannt waren und dieses Wissen über die Jahrtausende überliefert und erweitert wurde.
Ganoderma lucidum (G. lucidum) ist ein sicheres, ungiftiges und vielseitiges Naturheilmittel, das seit mehr als 2400 Jahren verwendet wird. (Ye u.a. 2023, S. 3)
In der traditionellen (chinesischen) Medizin spiegelt sich die Rolle von G. lucidum bei der Stärkung des gesunden Qi und der Beseitigung der pathogenen Faktoren in der Remobilisierung der körpereigenen Reparaturfähigkeit, der Verbesserung des inneren Millieus und der Ermöglichung eines Zustands des Yin- und Yang
Gleichgewichts des Körpers wider. (Ye u.a. 2023, S. 3)
Diverse Studien legen nahe, dass Ganoderma lucidum auf eine Vielzahl von Erkrankungen positiven Einfluss hat, so zum Beispiel auf Asthma (Liu u.a. 2022, S. 1237), Fettleber (Chiu u.a. 2017), Alzheimer (Oke u.a. 2022, S. 1) und Schlafstörungen (Mitra u.a. 2024).
So wird auch die Übersetzung der chinesischen Bezeichnung für G. lucidum verständlich wo er Lingzhi heißt, das bedeutet übersetzt soviel wie „Pilz der Unsterblichkeit“, „Zehntausend-Jahre-Pilz“ oder „Pilz des langen Lebens“ und lässt die Bedeutung in der Traditionellen Chinesischen Medizin (TCM) erkennen.
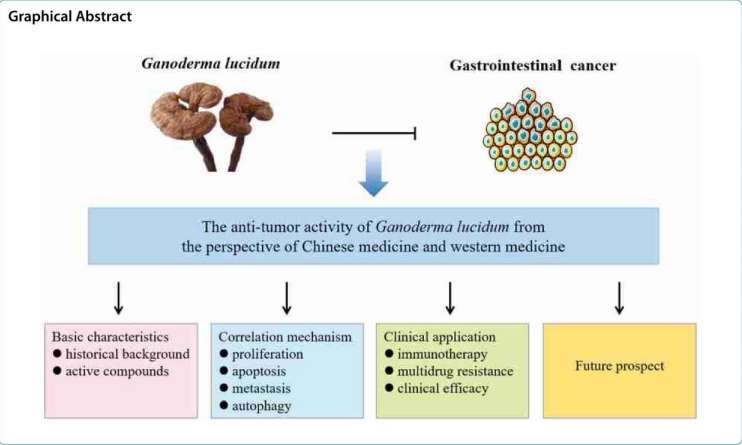
Abbildung 2: Grafische Zusammenfassung der Wirkungen von G. lucidum (Ye u.a. 2023, S. 2)
2.2 Biologische Einordnung
Laut der Ausgabe 2020 des Chinese Pharmacopoeia ist G. lucidum der getrocknete Fruchtkörper von Ganoderma lucidum, einer Pilzart aus der Familie der Poraceae. (Ye u.a. 2023, S. 3)
2.3 Pharmakologisch wirksame Bestandteile
Verschiedene Gruppen chemischer Verbindungen, einschließlich Triterpenoide (wie z.B. Lucdadiol), Polysaccharide, Proteine, Aminosäuren, Nukleoside, Alkaloide, Steroide, Lacton, Lektine, Fettsäuren und Enzyme mit potenten pharmakologischen Wirkungen, wurden aus dem Myzel und den Fruchtkörpern von G. lucidum isoliert. Mehrere Forscher (siehe Tabelle 1) haben über die Fülle und Diversifizierung ihrer biologischen Handlungen berichtet, die durch diese chemischen Verbindungen ausgelöst wurden. Triterpenoide und Polysaccharide von G. lucidum besitzen zytotoxische, hepatoprotektive, antihypertensive, cholesterinsenkende und antihistaminische Wirkungen sowie antioxidative, antimikrobielle, antiinflammatorische, hypoglykämische, antiallergische, neuroprotektive, antitumorale, immunmodulatorische und antiangiogene Eigenschaften. (Oke u.a. 2022, S. 1)
Tabelle 1: Allgemeine pharmakologische Wirkungen der wichtigsten bioaktiven Bestandteile von G. lucidum. (Oke u.a. 2022, S. 9)

Im weiteren Verlauf wenden wir uns gezielt auch dem Inhaltsstoff Lucidadiol zu. Lucidadiol ist ein bioaktives Sterol, das aus Ganoderma lucidum isoliert wurde.
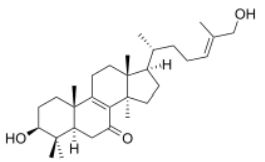
Abbildung 3: Strukturformel Lucidadiol (Shin u.a. 2021)
Es wurde berichtet, dass G. lucidum mehrere wichtige Substanzen einschließlich Polysaccharide, Proteine und Triterpenoide (siehe auch Tabelle 1) mit starker immunmodulatorischer Wirkung enthält. (Liu u.a. 2022, S. 1237)
2.4 Chancen in Bezug auf weitere Erkrankungen:
Heutzutage wird dieser Pilz und verwandte Produkte nach der erfolgreichen künstlichen Kultivierung von G. lucidum nicht nur als Gesundheitsnahrung, sondern auch als klinisches Medikament zur Vorbeugung und Behandlung von Hepatopathie, chronischer Hepatitis, Nephritis, Magengeschwüren, Bluthochdruck, Arthritis, Neurasthenie, Schlaflosigkeit, Asthma, akuter und chronischer Bronchitis, Leukopenie und Krebs eingesetzt. (Liu u.a. 2022, S. 1237)
Ganoderma lucidums (G. lucidum) Polysaccharide und Triterpenoide sind die wichtigsten bioaktiven Verbindungen und werden seit der Antike als traditionelle Medizin verwendet. Die große Nachfrage nach G. lucidum hat die Forscher fasziniert, die sich für seine Verwendung als funktionelles Lebensmittel, Nutrazeutikum und moderne Medizin interessieren, da es eine breite Palette von Anwendungen bei verschiedenen Krankheiten gibt, darunter als Immunmodulator, Antikrebsmittel, antivirales Mittel, Antioxidant, kardioprotektives und hepatoprotektives Mittel. Die Polysaccharide von G. lucidum weisen immunmodulatorische Eigenschaften auf, indem sie die Wirkung der antigenpräsentierenden Zellen, des mononukleären Phagozytensystems sowie der humoralen und zellulären Immunität verstärken. Es wird erwartet, dass die aus G. lucidum isolierten β-Glucane durch pathogenassoziierte molekulare Muster (PAMPs) eine Immunantwort hervorrufen. β Glucane erzeugen nach der Bindung an den Dectin-1-Rezeptor, der auf verschiedenen Zellen wie Makrophagen, Monozyten, dendritischen Zellen und Neutrophilen vorhanden ist, eine Signaltransduktion, die zur Auslösung der mitogenaktivierten Proteinkinasen (MAPKs), T-Zellen und des Kernfaktors-κB (NF κB) führt, die sich auf die Produktion von Zytokinen beziehen und zur Immunantwort beitragen, während Triterpenoide durch die Hemmung verschiedener Enzyme wie Neuraminidase, HIV-Protease, DENV2 NS2B-NS3-Protease und HSV-Vermehrung antivirale Wirkungen entfalten. Polysaccharide und Triterpenoide können als Ergänzung zu anderen Arzneimitteln bei der Prävention und Behandlung verschiedener Krankheiten eingesetzt werden. Die immunmodulierenden und antiviralen Eigenschaften dieses Pilzes könnten eine potenzielle Quelle zur Bekämpfung der (2021) aktuellen (Covid) Pandemie sein. (Ahmad u.a. 2021)
3. Ziel
Hier soll herausgearbeitet werden, ob G. lucidum 1. als Alleintherapeutikum, 2. als Wirkverstärker der Chemotherapie oder 3. zum Lindern der Nebenwirkungen der Chemotherapie eingesetzt werden und so die konventionelle Behandlung verbessern kann. Bislang liegen keine wissenschaftlichen Projekte in deutscher Sprache vor und somit ist diese Sammlung und Übersetzung von Erkenntnissen eine Neuerung.
4. Theorieteil
Menschliche Krebserkrankungen treten in ihrer Fülle häufig auf, sind auf verschiedene Weise lebensbedrohlich und sind oft nur mit sehr intensiven Gegenmaßnahmen zu bekämpfen. Wenngleich die Wissenschaft immer feiner die verschiedenen Pathomechanismen von Krebserkrankungen erforscht und daraus bessere Therapiemöglichkeiten entwickelt, bleibt die Behandlung oft schwierig.
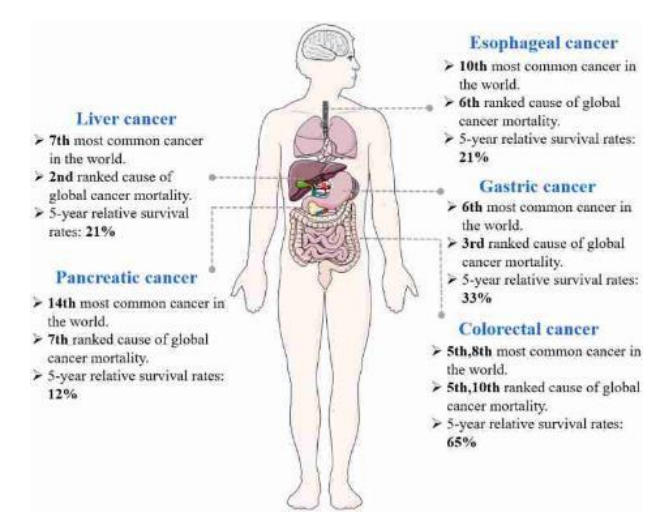
Abbildung 4: Die Verbreitung von Magen-Darm-Krebs, ihre Platzierung unter den 10 häufigsten Krebsarten der Welt und die Ursachen der weltweiten Krebssterblichkeit sowie die relativen 5-Jahres-Überlebensraten (Ye u.a. 2023, S. 3)
G. lucidum übt eine Anti-Tumor-Aktivität hauptsächlich durch Hemmung der Proliferation, Induktion der Apoptose, Hemmung der Metastasierung und Regulierung der Autophagie aus. Die Zellproliferation, ein lebenswichtiger Bestandteil von Zellwachstum und -differenzierung, ist auch ein wichtiges Lebensmerkmal von Organismen. Bei Krebs ist jedoch die abnorme Zellproliferation ein Schlüsselfaktor für seine Entwicklung (Shi u.a. 2019). Deshalb ist die Hemmung der Zellproliferation ein effektiver Weg zur Krebsbekämpfung. (Ye u.a. 2023, S. 5)
5. Methode
Qualitative Arbeit per Literaturanalyse, Suche: Ganoderma lucidum and cancer IdentificationSuche in PubMed
6. Ergebnisse
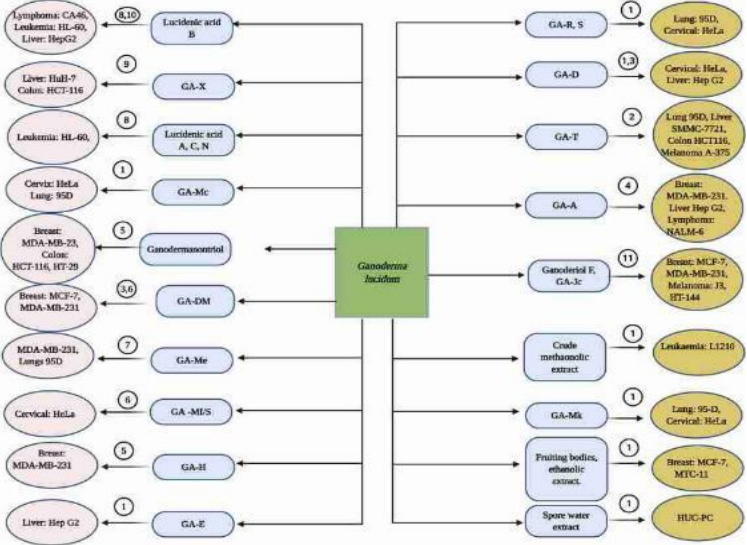
Abbildung 5: G. lucidum-Triterpenoide mit ihren Ziel-Krebszellen. (1) zytotoxisch; (2) hemmen die Proliferation und die Koloniebildung; (3) hemmen die Proliferation; (4) hemmen die Proliferation, die Koloniebildung, unterdrücken die Zellmigration, die Invasion und die Apoptose; (5) unterdrücken die Zellmigration, die Invasion, hemmen die Proliferation und die Koloniebildung; (6) induzieren die Apoptose und den Zellzyklus-Stillstand; (7) hemmen Zellproliferation, Invasion, Migration, Adhäsion und Angiogenese; (8) induzieren ZellzyklusArrest und hemmen das Wachstum der Zellpopulation; (9) induzieren Apoptose und Hemmung von Topoisomerasen; (10) induzieren Apoptose; (11) induzieren Zellzyklus-Arrest, Apoptose und hemmen Zellproliferation und Koloniebildung. Abbildung erstellt mit Biorender (https://biorender.com). (Ahmad 2020)
6.1 Eine Aktivität gegen Krebs allein durch G. lucidum wird zum Beispiel in folgenden Untersuchungen genannt:
G. lucidum übt eine Anti-Tumor-Aktivität hauptsächlich durch Hemmung der Proliferation, Induktion der Apoptose, Hemmung der Metastasierung und Regulierung der Autophagie aus (Ye u.a. 2023, S. 5)
Ein MTT-Assay ist ein Test, der die Zellviabilität und Zellproliferation misst. Er basiert auf der Reduktion des gelben Farbstoffs MTT in violette Formazan-Kristalle, dieser wurde von Shin und Mitarbeitern in der nachfolgend zieterten Studie genutzt.
Um die Auswirkungen von Lucidadiol auf die Lebensfähigkeit von B16- Melanomzellen zu bewerten, wurde der MTT-Test bei verschiedenen Lucidadiol Konzentrationen
(0-50 µM) und Inkubationszeiten (0, 12, 24 und 48 Stunden) durchgeführt. Die Ergebnisse zeigten, dass Lucidadiol die Lebensfähigkeit von B16-Melanomzellen in einer konzentrationsabhängigen (IC50-Werte von 48,42 µM bei 24 h) (Abb. 6 links) und zeitabhängigen Weise (mit 15 und 25 µM) verringerte (Abb. 6 rechts).
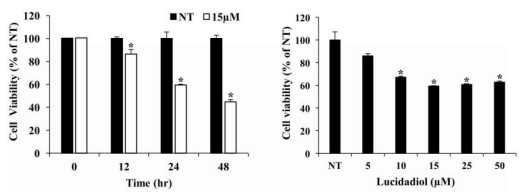
Abbildung 6: Die Zellen wurden 24 Stunden lang mit Lucidadiol in verschiedenen Konzentrationen oder 0, 12, 24 und 48 Stunden lang mit 15 µM behandelt. Die Lebensfähigkeit der Zellen wurde mit dem MTT-Test gemessen. (Shin u.a. 2021, S. 2)
In ähnlicher Weise testeten sie die Überlebensrate der Zellen nach Lucidadiol Behandlung mittels Trypanblau- und Kristallviolett-Färbung. Die Anzahl der mit Kristallviolett gefärbten Zellen und der mit Trypanblau ungefärbten Zellen entsprach der Anzahl der lebensfähigen Zellen (MTT-Assay) (Abb. 7).
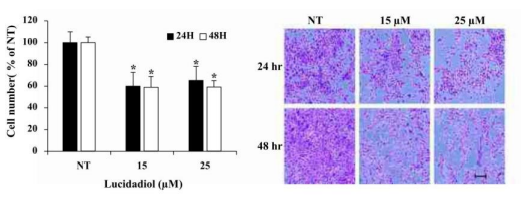
Abbildung 7: Die Lebensfähigkeit der Zellen wurde mittels Trypanblau- und Kristallviolett Färbung nach 24- und 48-stündiger Behandlung mit/ohne Lucidadiol bestimmt. Maßstab = 100 µm. (Shin u.a. 2021, S. 2)
Darüber hinaus untersuchten sie die antiproliferative Wirkung von Lucidadiol mithilfe eines Koloniebildungstests. Ihre Ergebnisse zeigen, dass Lucidadiol die Anzahl der Kolonien von B16-Melanomzellen reduziert (Abb. 8).
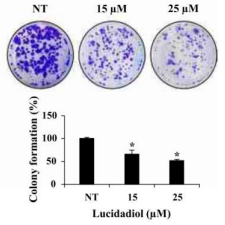
Abbildung 8: Die Kolonien wurden mit Kristallviolett angefärbt und mit einem Mikroplattenlesegerät analysiert. Die Daten sind als Mittelwert ± SD angegeben. *p < 0,05 im Vergleich mit der Kontrollgruppe (Shin u.a. 2021, S. 2)
Diese Daten deuten also darauf hin, dass die Behandlung mit Lucidadiol die Lebensfähigkeit und das Wachstum von Melanomzellen verringern kann. (Shin u.a. 2021)
In dieser Studie induzierte GLP den Beginn der Autophagie in HT-29- und HCT116- Zellen des kolorektalen Karzinoms (CRC), was durch erhöhte Werte des LC3-II Proteins und GFP-LC3-Puncta sowie eine vermehrte Bildung von Doppelmembranvakuolen belegt wurde. (Pan u.a. 2019, S. 1)
Laut Pan u.a. 2019 zeigten Zelllebensfähigkeits- (MTT-Test) und Durchflusszytometrie-Tests, dass die GLP-induzierte Autophagosomen-Akkumulation für die GLP-induzierte Apoptose in CRC-Zellen verantwortlich ist. Im Einklang damit schwächte die Hemmung der Autophagie-Initiierung durch 3-Methyladenin (3-MA), einen Autophagie-Inhibitor in der Frühphase, die GLP-induzierte Apoptose ab. Im Gegensatz dazu verstärkte die Unterdrückung der Autophagie im Spätstadium durch Chloroquin (CQ) die krebshemmende Wirkung von GLP. Darüber hinaus konnte nachgewiesen werden, dass die GLP-induzierte Autophagosomen-Akkumulation und Apoptose über eine MAPK/ERK-Aktivierung vermittelt wird. Schließlich hemmte GLP das Tumorwachstum und auch den autophagischen Fluss in vivo. Diese Ergebnisse enthüllten neue molekulare Mechanismen, die der krebshemmenden Wirkung von GLP zugrunde liegen, und deuten darauf hin, dass GLP ein wirksamer Autophagie Inhibitor ist und in der Krebstherapie von Nutzen sein könnte. (Pan u.a. 2019, S. 1)
Ganoderinsäure A (GA-A), ein Triterpenoid, unterdrückt nachweislich die Zellproliferation bei verschiedenen Krebsarten, darunter Brustkrebs und Osteosarkom. Seine Wirkung auf das menschliche hepatozelluläre Karzinom (HCC) ist jedoch noch nicht geklärt. Ziel der vorliegenden Studie war es, die Wirkung von GA-A auf HCC-Zellen in vitro zu untersuchen. Die menschlichen HCC-Zelllinien HepG2 und SMMC7721 wurden 24, 48 und 72 Stunden lang mit unterschiedlichen GA-A-Konzentrationen behandelt. Die Zellwachstumsrate, der Zellzyklus und die Apoptose, die Migration und die Invasion wurden mit einem Cell Counting Kit-8, der Durchflusszytometrie bzw. mit Transwell-Assays bestimmt. Die Expression von Apoptose-assoziierten Proteinen wurde mittels Western-Blot-Analyse nachgewiesen. GA-A hemmte die Proliferation der menschlichen HCC-Zellen HepG2 und SMMC7721 signifikant und in dosisabhängiger Weise. Darüber hinaus induzierte GA-A einen Zellzyklusarrest in der G0/G1-Phase und Apoptose und unterdrückte die Migration und Invasion von HCC-Zellen. Darüber hinaus verringerte GA-A die Expression von Cyclin D1 und erhöhte die Expression von p21 und gespaltener Caspase-3. Zusammenfassend lässt sich sagen, dass GA-A die Proliferation menschlicher HCC-Zellen in vitro unterdrückte und als vielversprechendes natürliches therapeutisches Reagenz bei der Behandlung von HCC wirken könnte. (Wang u.a. 2017, S. 3894)
6.2 Als Wirkverstärker für konventionelle Krebsbehandlungen finden einige Arbeiten Belege.
So versuchten Rahimnia und Mitarbeiter in ihrer 2023 veröffentlichten Arbeit festzustellen, ob die kombinierte Behandlung von routinemäßig verwendeten Arzneimitteln mit natürlichen, aus Pflanzen gewonnenen Produkten, einschließlich Ganoderma lucidum Polysaccharid-Extrakt, die Limitierungen von Arzneimitteln wie Flutamid und Docetaxel bei Patienten überwinden kann. Die Antitumoraktivität von Ganoderma lucidum-Polysaccharid, einschließlich der Verringerung des Zellwachstums, der Induktion von Apoptose und Zelltod, der Verringerung der Invasion und der Zellmigration, wurde in verschiedenen Studien durch die Signalisierung verschiedener Wege nachgewiesen. Zum ersten Mal zeigten Rahimnias Ergebnisse, dass Ganoderma lucidum Polysaccharid-Pflanzenextrakt die Apoptose in beiden Prostatakrebs-Zelllinien erhöht und den EMT-Signalweg und den KLK2-Biomarker moduliert, was zu einem besseren Ansprechen auf die Behandlung führt. (Rahimnia u.a. 2023, S. 11)
Insgesamt kann Ganoderma lucidum Polysaccharid die Apoptoseinduktion verstärken, das Zellwachstum, die Migration, die Kolonisierung und die Angiogenese hemmen und die Prostatakrebszellen für die Chemotherapie mit Flutamid und Docetaxel sensibilisieren. Aufgrund ihrer antiandrogenen Aktivität kann diese Verbindung als potenzieller Ansatz zur Behandlung von Prostatakrebs verwendet werden. Dementsprechend könnte die Kombination von Ganoderma lucidum Polysaccharid mit Flutamid oder Docetaxel eine neue therapeutische Strategie gegen Prostatakrebs darstellen. (Rahimnia u.a. 2023, S. 16)
Da Studien zeigen, dass der Heilpilz Ganoderma lucidum (GLE) Krebszellen für Bestrahlung und andere Medikamente sensibilisiert, wollte Suárez-Arroyo das therapeutische Potenzial von GLE allein oder in Kombination mit Carboplatin in Brustkrebsmodellen untersuchen. Seine Studien konzentrierten sich auf die Regulierung der DNA-Schadensreaktion (DDR) und auf die Stammzellenfunktion von Krebszellen. Carboplatin und GLE wurden in vitro an der IBC-Zelllinie (Inflammatory Breast Cance) SUM-149 und an Nicht-IBC-Brustkrebszellen MDA-MB-231 sowie in vivo an IBC-Xenograft-Modellen getestet. Die Ergebnisse zeigen, dass die Kombination aus GLE und Carboplatin die Lebensfähigkeit der Zellen verringerte, den Zelltod durch zwei verschiedene Mechanismen auslöste und die Reaktion auf DNA-Schäden verzögerte. Darüber hinaus unterdrückte die Kombination die Bildungvon Mammosphären und die Expression von Krebsstammzellproteinen. In Xenotransplantationsmodellen zeigte die Kombination signifikante tumorwachstumshemmende Wirkungen ohne systemische Toxizität. Diese Studie unterstreicht das Potenzial dieser dualen Therapie für IBC-Patienten. (Suárez-Arroyo u.a. 2022, S. 1282)
Zusammenfassend lässt sich sagen, dass die Studie bewiesen hat, dass Sporoderm broken spores of Ganoderma lucidum (SBSGL) die Antitumorwirkung von Cisplatin auf Ovarialtumore verstärken und die durch Cisplatin verursachte Darmschädigung und Myelosuppression in vivo abschwächen kann. Der Mechanismus stand im Zusammenhang mit dem erhöhten reaktiven Sauerstoffarten (reactive oxygen species = ROS), gefolgt von der Hemmung des ERK-Signalweges. Zusammenfassend lässt die Studie den Schluss zu, dass SBSGL für Eierstockkrebspatientinnen unter Cisplatin-Chemotherapie von Vorteil ist und dass Ganoderinsäure D (GAD) eine vielversprechende Komponente ist, die eine weitere Entwicklung und klinische Überprüfung verdient. (Cen u.a. 2022, S. 12)
Eine andere Zusammenfassung zeigte, dass GLC (Ganoderma lucidum) eine erhebliche Wirkung auf CRC-Zellen durch die Induktion oxidativer DNA-Schäden hat, während es nichtmaligne Zellen vor der Ansammlung von ROS schützte. Darüber hinaus verstärkte GLC die toxische Wirkung von 5FU in CRC-Zelllinien. Aufgrund der erhaltenen Ergebnisse schlagen Opattova und Kollegen vor, dass Naturstoffe eine vielversprechende Ergänzung zur konventionellen Krebstherapie darstellen könnten, die letztendlich die effektive kurative Dosis von Krebsmedikamenten reduzieren und die Patientenergebnisse verbessern könnte. (Opattova u.a. 2019, S. 9)
Leukopenie und eine Beeinträchtigung des Immunsystems treten in der Regel während einer Krebstherapie auf. Citronellol, eine aus der Geranie gewonnene öllösliche Verbindung, hat krebs- und entzündungshemmende Eigenschaften und fördert die Wundheilung. Ganoderma lucidum, Codonopsis pilosula und Angelicae sinensis sind traditionelle chinesische Heilkräuter, deren immunmodulatorische Wirkung in laborgestützten Untersuchungen nachgewiesen wurde. In dieser randomisierten, doppelblinden, placebokontrollierten Studie wurde untersucht, ob der chinesische Heilkräuterkomplex (CCMH; eine Mischung aus Citronellol und Extrakten von G. lucidum, C. pilosula und A. sinensis) die Anzahl der Immunzellen von Krebspatienten verbessert, die eine Chemo- und/oder Strahlentherapie erhalten. Insgesamt wurden 105 Krebspatienten, die eine Chemo- oder Strahlentherapie erhielten, in die Studie aufgenommen. Die Menge der Immunzellen im Blut der Probanden wurde vor und nach einer 6-wöchigen Krebsbehandlung mit CCMH oder einem Placebo bestimmt. CCMH reduzierte signifikant die Abnahme der Leukozyten (14,2 % im Vergleich zu 28,2 %) und der Neutrophilen (11,0 % im Vergleich zu 29,1 %). Die Analyse des Lymphozytenphänotyps ergab, dass die Patienten, die das Placebo erhielten, weniger CD4-Lymphozyten und natürliche Killerzellen (NK) aufwiesen als die mit CCMH behandelten Patienten. Die Behandlung mit CCMH bei Patienten, die eine Chemo- und/oder Strahlentherapie erhalten, kann ihre Immunfunktion verbessern und damit ihre Fähigkeit, den Krebs und eventuelle Sekundärinfektionen, die ihre Behandlung und ihre Gesundheit gefährden könnten, zu bekämpfen. (Zhuang u.a. 2009, S. 785)
6.3 Nebenwirkungen der konventionellen Krebstherapie werden gelindert nach:
Die von Rahimnia und Mitarbeitern vorgelegte Studie zeigte, dass Ganoderma lucidum-Polysaccharid die Prostatakrebs-Zelllinien für niedrigere Dosen von Docetaxel und Flutamid sensibilisiert. Außerdem zeigten die Ergebnisse der Durchflusszytometrie, dass es die Nekrose und damit die durch die Standardmedikamente verursachte Toxizität reduziert und additive und synergistische Effekte hat, wenn es zusammen mit Flutamid und Docetaxel verwendet wird. (Rahimnia u.a. 2023, S. 15)
Liu und Kollegen führten eine randomisierte doppelblinde placebokontrollierte Studie durch, diese ergab eine vorläufige Wirksamkeit und Sicherheit von Reishi & Privet Formula (RPF), einem pflanzlichen Produkt aus Reishi-Pilzen, bei der Verbesserung der Lebensqualität von Patienten mit nicht-kleinzelligem Lungenkrebs, die sich einer Chemotherapie unterziehen. Diese vorläufigen Ergebnisse müssen in angemessenen, gut konzipierten klinischen Studien überprüft werden, um die endgültige Sicherheit und Wirksamkeit von RPF festzustellen. (Liu u.a. 2020)
6.4 Alle vorgenannten Eigenschaften werden durch Gao/Homayoonfal 2023 erfasst:
Deren Ergebnisse zeigen, dass Ganoderma lucidum Polysaccharide (GLPs) über verschiedene Mechanismen krebshemmende Wirkungen entfalten, darunter Zytotoxizität, antioxidative Eigenschaften, Apoptoseinduktion, Erzeugung reaktiver Sauerstoffspezies (ROS) und antiproliferative Effekte. Darüber hinaus wurde das Potenzial von Nanopartikeln (NP) auf GLP-Basis als Träger für bioaktive Inhaltsstoffe untersucht. Diese auf GLPs basierenden NPs sind so konzipiert, dass sie auf verschiedene Krebsgewebe abzielen und die biologische Aktivität der eingekapselten Verbindungen verstärken. Somit stellen die aus G. lucidum gewonnenen GLPs einen vielversprechenden Weg dar, um das Fortschreiten von Krebs zu hemmen, die mit der Chemotherapie verbundenen Nebenwirkungen zu minimieren und ihre Verwendung in Kombinationstherapien als natürliche Ergänzung zu unterstützen. (Gao/Homayoonfal 2023, S. 1)
7. Diskussion
Die gefundenen Studien untermauern die These, dass Ganoderma lucidum eine Chance in der modernen Krebstherapie in Bezug auf die untersuchten Krebsarten darstellt, da dieser Pilz Inhhaltsstoffe besitzt, die schon für sich allein betrachtet krebsbekämpfende Eigenschaften besitzen. Auch die wirkungsverstärkenden und dosissenkenden Eigenschaften scheinen gut belegbar zu sein und nicht zuletzt auch die Reduktion von Nebenwirkungen stellt eine Chance dar.
Da nur einige in vivo Studien an Menschen verfügbar sind und diese eher kleine Patientenzahlen aufweisen, sollte die Sicherheit und die gefundenen positiven Wirkungen bei einer größeren Zahl von Patienten wiederholt nachgewiesen werden. Eine Studie hat in einer rein chinesischen Population stattgefunden und sollte in einer ethnisch gut gemischten Gruppe verifiziert werden.
Eine Limitierung der Arbeit stellt dar, dass hier nicht die ganze Bandbreite von allen Krebserkrankungen dargestellt werden kann.
Weiterhin wurde hier aufgrund des zur Verfügung stehenden Rahmens überwiegend auf aktuellere Studien zurückgegriffen, die nicht älter als 10 Jahre sind, da ältere Erkentnnisse bereits als Grundlagen in die aktuelleren Studien eingeflossen sind. Somit sind teilweise nicht die tatsächlichen Primärquellen dargestellt, sondern auch Vertrauen darin gesetzt worden, dass die Grundlagen bereits vernünftig Peer Reviewed sind und diese dann zugrunde gelegt wurden.
8. Zusammenfassung
Die vorliegende Arbeit untersucht die mögliche Rolle von Ganoderma lucidum (Reishi) bei der Behandlung menschlicher Krebserkrankungen und bewertet dessen Wirksamkeit als alleinstehendes Therapeutikum, Wirkverstärker für Chemotherapien oder Mittel zur Linderung von Nebenwirkungen der Chemotherapie.
Einleitung: Ganoderma lucidum ist ein traditionelles chinesisches Heilmittel, das seit über 2.400 Jahren verwendet wird. Historische und biochemische Einordnungen beschreiben es als Pilz mit potenten pharmakologischen Effekten, die eine Vielzahl von chemischen Verbindungen wie Triterpenoide und Polysaccharide umfassen. Diese besitzen zahlreiche gesundheitsfördernde Eigenschaften, darunter antitumorale und immunmodulatorische Wirkungen.
Ziel: Die Arbeit zielt darauf ab, die Effektivität von G. lucidum im Kontext der Krebsbehandlung zu erforschen und festzustellen, ob es alleine, als Wirkverstärker oder zur Linderung von Nebenwirkungen der Chemotherapie eingesetzt werden kann.
Methodik: Die Arbeit basiert auf einer qualitativen Literaturanalyse von Studien der letzten 10 Jahre, die sich auf die antitumoralen Eigenschaften von G. lucidum konzentrieren. Materialien umfassen randomisierte Doppelblindstudien sowie in vitro und in vivo Experimente.
Ergebnisse:
1. Antitumorale Wirkung: G. lucidum zeigt signifikante Effekte wie die Hemmung der Zellproliferation, Induktion der Apoptose und Hemmung der Metastasierung in verschiedenen Krebszelllinien.
2. Wirkverstärkende Eigenschaften: diverse Studien zeigen, dass G. lucidum die Wirksamkeit von konventionellen Krebsmedikamenten wie Flutamid und Docetaxel oder auch Cisplatin erhöht und die Krebszellen für diese sensibilisiert.
3. Linderung von Nebenwirkungen Chemo- oder Strahlentherapie: Ebenfalls wurde nachgewiesen, dass G. lucidum die durch Chemotherapie verursachte Toxizität verringert und die immunologische Erholung während der Behandlung unterstützt.
Schlussfolgerung: Ganoderma lucidum hat das Potenzial, die Behandlung von Krebserkrankungen zu unterstützen, sei es als eigenständiges Therapeutikum, in Kombination mit Chemotherapie zur Wirkverstärkung oder zur Reduzierung der Nebenwirkungen. Diese Eigenschaften machen es zu einer vielversprechenden natürlichen Ergänzung in der Krebsbehandlung. Weitere klinische Studien sind jedoch notwendig, um die Wirksamkeit und Sicherheit im klinischen Setting umfassend zu belegen.
9. Anhang
Abkürzungen:
CCMH = Citronellol und Extrakten von G. lucidum, C. pilosula und A. sinensis (Mischung chinesischer Heilkräuter)
CRC = Colorectal cancer
DDR = DNA-Schadensreaktion
GA = Ganoderic acids
GA-A = Ganoderic acid A
GAD = Ganoderic acid D
GLC = GLE = G. lucidum = Ganoderma lucidum
GLP =GLPs = G. lucidum polysaccharides
GLT = G. lucidum triterpenoids
HCC = hepatozelluläres Karzinom
IBC = Inflammatory Breast Cancer
LA = Lucidenic acids
MAPKs = mitogenaktivierten Proteinkinasen
NP = Nanopartikeln
NK = natürliche Killerzellen
PAMPs = pathogenassoziierte molekulare Muster
ROS = reaktiver Sauerstoffspezies
RPF = Reishi & Privet Formula
SBSGL = Sporoderm-broken spores of Ganoderma lucidum
TCM = Traditionellen Chinesischen Medizin
Literatur:
Ahmad, M.F. (2020): Ganoderma lucidum: A rational pharmacological approach to surmount cancer. In: Journal of Ethnopharmacology 260, S. 113047.
Ahmad, M.F./Ahmad, F.A./Khan, M.I./Alsayegh, A.A./Wahab, S./Alam, M.I./Ahmed, F. (2021): Ganoderma lucidum: A potential source to surmount viral infections through β-glucans immunomodulatory and triterpenoids antiviral properties. In: International Journal of Biological Macromolecules 187, S. 769–779.
Cen, K./Chen, M./He, M./Li, Z./Song, Y./Liu, P./Jiang, Q./Xu, S./Jia, Y./Shen, P. (2022): Sporoderm Broken Spores of Ganoderma lucidum Sensitizes Ovarian Cancer to Cisplatin by ROS/ERK Signaling and Attenuates Chemotherapy-Related Toxicity. In: Frontiers in Pharmacology 13, S. 826716.
Chiu, H.-F./Fu, H.-Y./Lu, Y.-Y./Han, Y.-C./Shen, Y.-C./Venkatakrishnan, K./Golovinskaia, O./Wang, C.-K. (2017): Triterpenoids and polysaccharide peptides-enriched Ganoderma lucidum: a randomized, double-blind placebo-controlled crossover study of its antioxidation and hepatoprotective efficacy in healthy volunteers. In: Pharmaceutical biology 55, H. 1, S. 1041–1046.
Gao, X./Homayoonfal, M. (2023): Exploring the anti-cancer potential of Ganoderma lucidum polysaccharides (GLPs) and their versatile role in enhancing drug delivery systems: a multifaceted approach to combat cancer. In: Cancer cell international 23, H. 1, S. 1–29.
Liu, C./Cao, M./Yang, N./Reid-Adam, J./Tversky, J./Zhan, J./Li, X.-M. (2022): Time-dependent dual beneficial modulation of interferon-γ, interleukin 5, and Treg cytokines in asthma patient peripheral blood mononuclear cells by ganoderic acid B. In: Phytotherapy research : PTR 36, H. 3, S. 1231–1240.
Liu, J./Mao, J.J./Li, S.Q./Lin, H. (2020): Preliminary Efficacy and Safety of Reishi & Privet Formula on Quality of Life Among Non-Small Cell Lung Cancer Patients Undergoing Chemotherapy: A Randomized Placebo-Controlled Trial. In: Integrative cancer therapies 19, 1534735420944491.
Mitra, S./Mitra, M./Nandi, D.K./Saha, M./Bandyopadhyay, A. (2024): Efficacy of Lingzhi or Reishi Medicinal Mushroom Ganoderma lucidum (Agaricomycetes) Supplementation on Psychological Stress and Selective Fitness Profile Parameters in Female College Students in West Bengal, India. In: International journal of medicinal mushrooms 26, H. 11, S. 51–64.
Oke, M.A./Afolabi, F.J./Oyeleke, O.O./Kilani, T.A./Adeosun, A.R./Olanbiwoninu, A.A./Adebayo, E.A. (2022): Ganoderma lucidum: Unutilized natural medicine and promising future solution to emerging diseases in Africa. In: Frontiers in Pharmacology 13, S. 952027.
Opattova, A./Horak, J./Vodenkova, S./Kostovcikova, K./Cumova, A./Macinga, P./Galanova, N./Rejhova, A./Vodickova, L./Kozics, K./Turnovcova, K./Hucl, T./Sliva, D./Vodicka, P. (2019): Ganoderma Lucidum induces oxidative DNA damage and enhances the effect of 5-Fluorouracil in colorectal cancer in vitro and in vivo. In: Mutation research. Genetic toxicology and environmental mutagenesis 845, S. 403065.
Pan, H./Wang, Y./Na, K./Wang, Y./Wang, L./Li, Z./Guo, C./Guo, D./Wang, X. (2019): Autophagic flux disruption contributes to Ganoderma lucidum polysaccharide-induced apoptosis in human colorectal cancer cells via MAPK/ERK activation. In: Cell Death & Disease 10, H. 6, S. 456.
Rahimnia, R./Akbari, M.R./Yasseri, A.F./Taheri, D./Mirzaei, A./Ghajar, H.A./Farashah, P.D./Baghdadabad, L.Z./Aghamir, S.M.K. (2023): The effect of Ganoderma lucidum polysaccharide extract on sensitizing prostate cancer cells to flutamide and docetaxel: an in vitro study. In: Scientific reports 13, H. 1, S. 1–19.
Shi, H.-J./Zhou, H./Ma, A.-L./Wang, L./Gao, Q./Zhang, N./Song, H.-B./Bo, K.-P./Ma, W. (2019): Oxymatrine therapy inhibited epidermal cell proliferation and apoptosis in severe plaque psoriasis. In: The British journal of dermatology 181, H. 5, S. 1028–1037.
Shin, S.-A./Lee, J.S./Joo, B.J./Ryu, G./Han, M./Kim, H./An, J./Koo, M.H./Youn, U.J./Lee, J.H./Park, H.H./Lee, C.S. (2021): Anti-cancer effects of lucidadiol against malignant melanoma cells. In: Applied Biological Chemistry 64, H. 1.
Suárez-Arroyo, I.J./Acevedo-Díaz, A./Ríos-Fuller, T.J./Ortiz-Soto, G./Vallejo-Calzada, R./Reyes-Chea, J./Maldonado-Martínez, G./Schneider, R.J./Martínez-Montemayor, M.M. (2022): Ganoderma lucidum enhances carboplatin chemotherapy effect by inhibiting the DNA damage response
pathway and stemness. In: American journal of cancer research 12, H. 3, S. 1282–1294. Wang, X./Di Sun/Tai, J./Wang, L. (2017): Ganoderic acid A inhibits proliferation and invasion, and promotes apoptosis in human hepatocellular carcinoma cells. In: Molecular medicine reports 16, H. 4, S. 3894–3900.
Wirz-Ridolfi, A. (2019): OETZI: die ganze Geschichte des Mannes aus dem Eis. In: Akupunktur & Aurikulomedizin 45, H. 3, S. 9–11.
Ye, T./Ge, Y./Jiang, X./Song, H./Peng, C./Liu, B. (2023): A review of anti-tumour effects of Ganoderma lucidum in gastrointestinal cancer. In: Chinese medicine.
Zhuang, S.-R./Chen, S.-L./Tsai, J.-H./Huang, C.-C./Wu, T.-C./Liu, W.-S./Tseng, H.-C./Lee, H.-S./Huang, M.-C./Shane, G.-T./Yang, C.-H./Shen, Y.-C./Yan, Y.-Y./Wang, C.-K. (2009): Effect of citronellol and the Chinese medical herb complex on cellular immunity of cancer patients receiving chemotherapy/radiotherapy. In: Phytotherapy research : PTR 23, H. 6, S. 785–790.
Abbildungen:
Abbildung 1: Ganoderma lucidum(Oke u.a. 2022, S. 7)
Abbildung 2: Grafische Zusammenfassung der Wirkungen von G. lucidum (Ye u.a. 2023, S. 2) Abbildung 3: Strukturformel Lucidadiol (Shin u.a. 2021)
Abbildung 4: Die Verbreitung von Magen-Darm-Krebs (Ye u.a. 2023, S. 3)
Abbildung 5: G. lucidum-Triterpenoide mit ihren Ziel-Krebszellen. (Ahmad 2020) Abbildung 6: Die Lebensfähigkeit der Zellen nach Behandlung mit Lucidadiol. (Shin u.a. 2021, S. 2) Abbildung 7: Die Zellen nach Trypanblau- und Kristallviolett-Färbung (Shin u.a. 2021, S. 2)
Abbildung 8: Die Kolonien wurden mit Kristallviolett angefärbt und mit einem Mikroplattenlesegerät analysiert. (Shin u.a. 2021, S. 2)
Tabellen:
Tabelle 1: Allgemeine pharmakologische Wirkungen der wichtigsten bioaktiven Bestandteile von G. lucidum. (Oke u.a. 2022, S. 9)
Hilfsmittel:
Die zugrundeliegende Literaturrecherche wurde manuell in PubMed durchgeführt und die Texte mit Citavi verwaltet und die entsprechenden Zitate nach „Der Deutschen Schule“ erstellt.
Generative Modelle/KI wurden erstens zur Erstsondierung der zur Verfügung stehenden Literatur benutzt und durch die vorgenannte Citavi-Recherche vollständig ersetzt und zweitens um einen Entwurf für die Zusammenfassung der Arbeit zu erstellen der weitgehend überarbeitet wurde.
Ganz besonderer Dank gilt Dr. Dirk Bremen für seine Korrekturlesung und Dr. med. dent. Roland Schule für seine Ermutigung und Unterstützung diese Arbeit zu veröffentlichen.